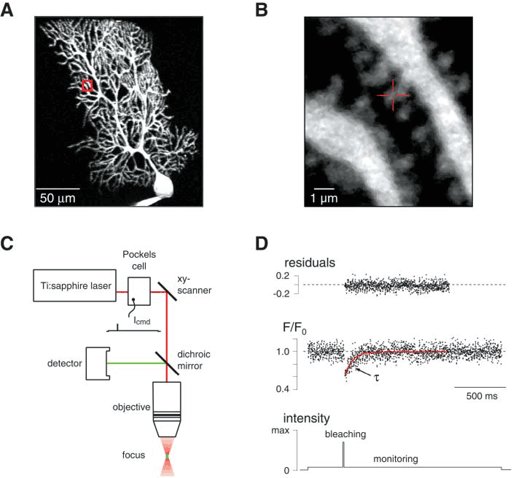
Mittels Fluoreszenzerholungsmessungen (fluorescence recovery after photobleaching, FRAP) quantifizieren wir die Beweglichkeit endogener Proteine im neuronalen Zytosol. Neben der Bestimmung der spezifischen Diffusionskoeffizienten erlaubt die Meßmethodik auch Protein-Protein-Interaktionen in submikrometer-großen Zellkompartimenten nachzuweisen. Wir erhoffen uns aus diesen Untersuchungen u.a. die Identifikation neuer, bisher nicht untersuchbarer Proteinwechselwirkungen in Nervenzellen.