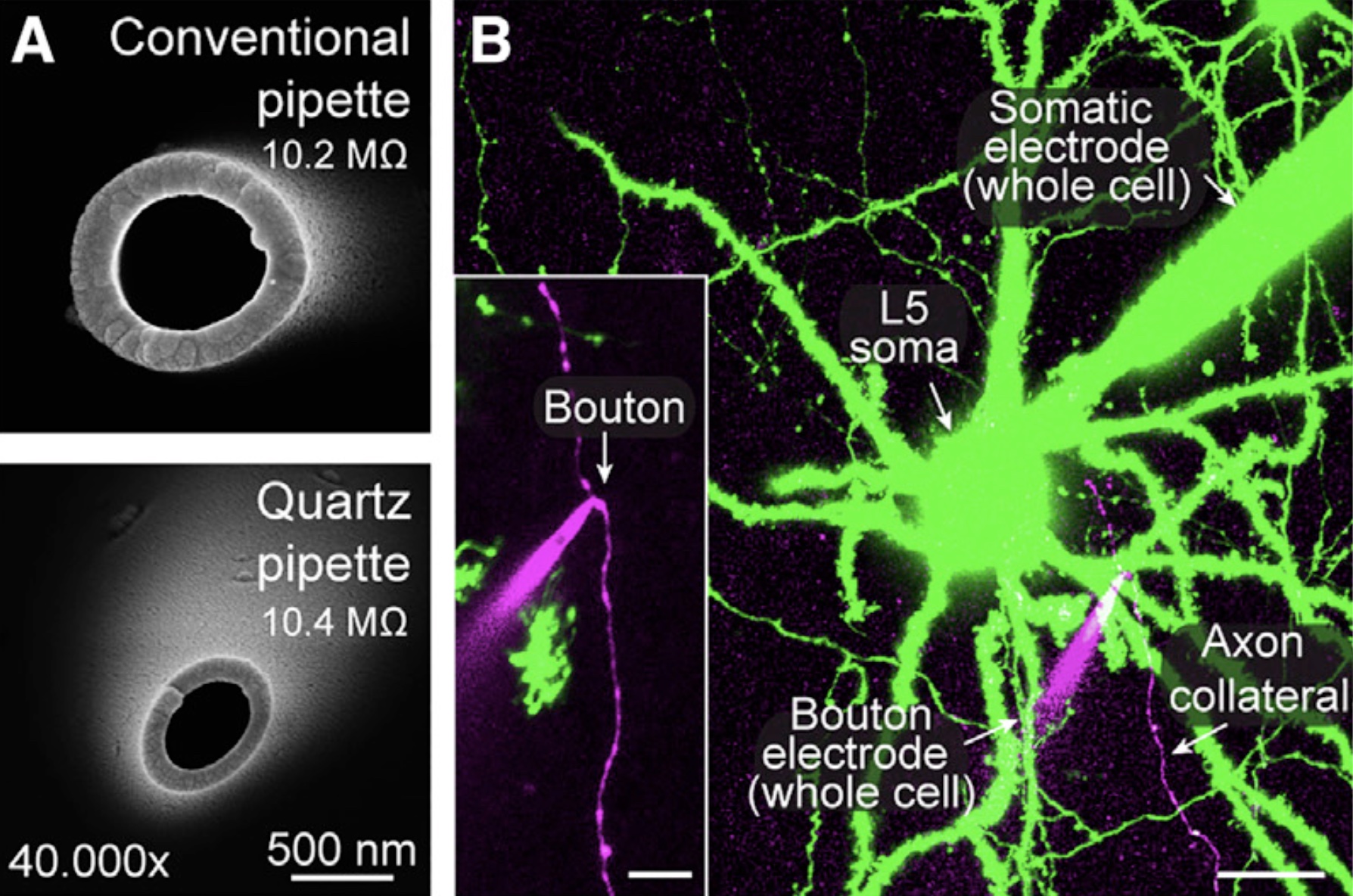
Um die präsynaptischen Mechanismen der chemischen synaptischen Übertragung zu untersuchen, führen wir Patch-Clamp-Ableitungen von präsynaptischen Nervenendigungen in akuten Hirnschnitten durch, darunter typische kleine Boutons im Neokortex (Ritzau-Jost et al, Cell Reports, 2021), dopaminerge Axone im Striatum (Liu et al., Science, 2022), Moosfaser-Boutons im Kleinhirn (Ritzau-Jost et al., Neuron, 2014) und Moosfaser-Boutons im Hippocampus (Hallermann et al., PNAS, 2003). Die Abbildung zeigt elektronenmikroskopische Aufnahmen der Spitze von Borosilikat- und Quarzglaspipetten (A) und eine Zwei-Photonen-Aufnahme einer gepaarten Ganzzell-Aufnahme vom Soma und Bouton eines Schicht-5-Pyramidalneurons (B; Maßstab 20 µm und 5 µm für den Inset; Ritzau-Jost et al., Cell Reports, 2021).